segunda-feira, 21 de novembro de 2022
domingo, 23 de outubro de 2022
quarta-feira, 12 de outubro de 2022
Atualização Regulatória da Cannabis Medicinal no Brasil
Jair Calixto jair@jaircalixto.com.br
Maria José D. Fagundes contato@mjdfagundes.com.br
1- Introdução
O uso de derivados do Cânhamo tem se acentuado no mundo todo e no Brasil. Diversas enfermidades estão sendo tratadas com CBD - Canabidiol (principalmente) e THC - Tetrahidrocanabinol. Em diversos países já existem produtos fora do âmbito farmacêutico, criando um cenário bastante promissor. Por outro lado, ainda que o uso humano de produtos de Cannabis esteja liberado no Brasil, percebe-se um desconhecimento por parte da sociedade em geral, incluindo classe médica e de outros profissionais da saúde.
Este artigo traz um resumo contendo diversas informações sobre o uso, comercialização, produção e qualidade, assim como as normas que regulam o assunto e os Projetos de Lei que buscam liberar plantio e extração.
2- Histórico
Conforme relata o mundialmente respeitado cientista e professor, Dr. Elisaldo Carlini, de uma certa maneira, a história do Brasil está intimamente ligada à planta Cannabis sativa L., desde a chegada das primeiras caravelas portuguesas em 1500. Não só as velas, mas também o cordame daquelas frágeis embarcações, eram feitas de fibra de cânhamo, como também é chamada a planta. Aliás, a palavra maconha em português seria um anagrama da palavra cânhamo¹.
A planta era utilizada na medicina, nas boticas para fabricação de xaropes, *pílulas para dor e para dormir, passando pela indústria automobilística, já que FORD desenvolvia combustíveis a base do óleo de Cannabis. Gutemberg imprimiu as primeiras 135 bíblias em papel de cânhamo, além do uso no setor têxtil, em Pesquisa Clínica e em medicamentos patenteados14, 15.
Já era cultivado havia séculos pelo mundo, dominava a indústria de tecidos, enquanto quase toda indústria do papel também estava baseada nessa matéria-prima. A planta também era usada como fumo pelos negros, imigrantes e incômodos intelectuais boêmios na Europa. Nos Estados Unidos, era utilizada pelas classes menos privilegiadas e vistas com antipatia pela classe média branca, como os imigrantes mexicanos.
As mudanças proibitivas até parecem uma notícia atual. Mas foi iniciada com a Lei Seca nos Estados Unidos, entre 1929/1930. O recém-criado Comitê de Proibição, espalhava que o aumento da criminalidade estava atrelado ao aumento do uso da Cannabis, mas a
*Pílulas: São formas farmacêuticas muito antigas, hoje pouco produzidas industrialmente. Foram substituídas gradativamente pelos comprimidos.
verdade revelada por historiadores é que a crise de 1929 – recessão mundial, aumentou a criminalidade naquele período.
A divulgação de reportagens sem fundamento científico sobre a planta, pelo lobby da indústria do petróleo, de tecidos sintéticos e papel concretizaram a criminalização da Cannabis, em 1930, naquele país.
Diplomatas americanos articularam internacionalmente e, influenciando a Liga das Nações Unidas e a ONU, conseguiram a proibição mundial da Cannabis na Convenção de 1961, incluindo o CBD e o THC nas listas de controle internacional.
Passados mais de 59 anos, o Comitê Experts em Dependência de Drogas da Organização Mundial de Saúde, por 6 anos estudou os reais impactos do Canabidiol e recomendou sua exclusão da Lista de Controle. Em dezembro de 2020, a Comissão de Drogas Narcóticas (CDN) da Organização das Nações Unidas (ONU) reclassificou a cannabis, retirando a planta e a resina extraída dela do anexo IV da Convenção sobre Drogas de 1961, reservado aos entorpecentes mais perigosos. Isso significa, que a cannabis deixou de estar, aos olhos da ONU, no grupo onde estão substâncias como a morfina, um opioide amplamente utilizado em medicamentos²
Com certeza, ainda é preciso buscar uma classificação mais adequada para a cannabis, visto que a própria morfina é muito mais perigosa do que os derivados da planta.
A ONU é responsável apenas por recomendações. As legislações seguem a cargo de cada país. Contudo, a mudança é um reconhecimento, após décadas de estudos científicos em torno do uso medicinal da cannabis, e deve ser um impulsionador para, cada vez mais, nações deixarem de criminalizar sua aplicação terapêutica. Deve, também, ser um elemento importante para o desenvolvimento de ainda mais pesquisas.
É interessante observar o posicionamento de especialistas no mercado de cannabis, como Robert Hoban, fundador e presidente do Hoban Law Group (HLG), consultoria jurídica norte-americana especializada em negócios de cannabis. Hoban, em artigo publicado na edição norte-americana da Revista Forbes, em 3 de dezembro de 2020, ressaltou que para ele, a decisão pode nos fazer avançar globalmente no viés econômico, na segurança dos pacientes e na reforma dos sistemas de justiça, altamente impactados em muitos países pela criminalização da cannabis ao longo das últimas décadas.
Outro fato importante, o esforço para a proibição contou com o uso dos veículos de comunicação e a participação de pessoas influentes e poderosas. Hoje outros homens com poder equivalente traçam estratégias pouco ortodoxas, entretanto a sociedade tem lutado em diferentes meios de comunicação para que o Estado viabilize o uso controlado da Cannabis para uso medicinal.
3- Cenário legislativo do uso de derivados da Cannabis sativa para fins medicinais
No Brasil a primeira lei que proibiu o uso da Cannabis foi em 1830, conhecida como a Lei “pito do Pongo”, aplicava pena mais rígida para o usuário - escravos e negros, e não para os traficantes que eram brancos e de classe média.
Ainda hoje é crime plantar, mesmo que pequenas quantidades e a pena é de advertência, prestação de serviço à Comunidade ou medidas educativas.
Até 1976 todas as outras Leis Brasileiras e até o Código Penal de 1940, mantiveram por cerca de 176 anos a proibição total no Brasil.
Desde a proibição em 1930, foi a Lei 6368/76 que iniciou a abertura para a regulamentação com a seguinte disposição:
Artigo 16. Adquirir, guardar ou trazer consigo, para o uso próprio, substância entorpecente ou que determine dependência física ou psíquica, sem autorização ou em desacordo com determinação legal ou regulamentar. Em 2006 foi concretizada a autorização no Parágrafo Único do artigo 2º da Lei 11.343.
Com relação à legislação brasileira e internacional sobre o uso e tráfico de drogas e entorpecentes, em 1988, mesmo ano da publicação da Constituição Federal brasileira, foi publicada a "Convenção das Nações Unidas contra o Tráfico Ilícito de Entorpecentes e Substâncias Psicotrópicas de 1988". Ela estabeleceu medidas abrangentes contra o tráfico ilícito de drogas, incluindo métodos contra a lavagem de dinheiro e o fortalecimento do controle de precursores químicos. Fornece, também, informações para uma cooperação internacional por meio, por exemplo, da extradição de traficantes de drogas, seu transporte e procedimentos de transferência.
A repressão ao uso e comercialização de substâncias entorpecentes se intensificou em 2006 com a vigência da Lei nº 11.343/06 (Lei de Drogas), a qual, em seus artigos 1º e 66, enquadra as substâncias constantes do Anexo I da Portaria SVS/MS nº 344/98 como definidoras das "drogas", objeto da proibição pela Lei de 2006, na qual se encontra, inclusive, a cannabis sativa.
Já o parágrafo 1º do artigo 28 desta mesma lei inclui na incidência de crime quem "para seu consumo pessoal, semeia, cultiva ou colhe plantas destinadas à preparação de pequena quantidade de substância ou produto capaz de causar dependência física ou psíquica".
No entanto, o parágrafo único do artigo 2º estabelece uma exceção, consistente:
Plantio, cultivo e colheita para fins medicinais ou científicos, com a possibilidade da autorização da União nesse sentido.
Isso quer dizer que existe, desde 2006, previsão autorizativa expressa para o cultivo e uso de cannabis sativa para fins medicinais, bem como a garantia do acesso aos tratamentos medicinais. No que se refere ao cultivo, até a presente data não houve uma definição sobre qual autoridade regulatória deverá disponibilizar ato regulatório próprio, se a ANVISA - Agência Nacional de Vigilância Sanitária ou o MAPA - Ministério da Agricultura, Pecuária e Abastecimento.
4- Atos infra legais – Ministério da Saúde - Conselho Federal de Medicina – CFM e ANVISA
O Ministério da Saúde no Brasil iniciou o processo de controle no Executivo, estabelecido pelas legislações vigentes, dando início publicou a Portaria SVS nº 344/199810, aprovando um regulamento técnico sobre substâncias e produtos sujeitos a controle especial. Em seu artigo 2º consta o seguinte:
Artigo 2º — Para extrair, produzir, fabricar, beneficiar, distribuir, transportar, preparar, manipular, fracionar, importar, exportar, transformar, embalar, reembalar, para qualquer fim, as substâncias constantes das listas deste Regulamento Técnico (Anexo I) e de suas atualizações, ou os medicamentos que as contenham, é obrigatória a obtenção de Autorização Especial concedida pela Secretaria de Vigilância Sanitária do Ministério da Saúde.
A Portaria SVS/MS nº 344/9810 é que aborda os critérios sobre a prescrição e dispensação de medicamentos sujeitos a controle especial.
Os médicos e farmacêuticos, devem prestar especial atenção aos adendos destas listas, pois os mesmos modificam a forma de prescrição e dispensação de algumas substâncias. Desse modo, em certos casos, uma substância presente em determinada lista poderá ser prescrita em receituário diferente do padrão da lista a qual pertence, conforme previsão do adendo que consta ao final de cada lista.
As listas presentes no Anexo I do referido regulamento, preveem a cannabis sativum na lista de "plantas que podem originar substâncias entorpecentes e/ou psicotrópicas", bem como o tetraidrocanabinol (THC) na lista de substâncias proibidas no Brasil. As disposições das listas foram atualizadas pela RDC nº 734, de 11 de julho de 2022 – ANVISA, publicada em 13 de julho de 2022 e traz as seguintes determinações.
Tabela 1- Listas atualizadas sobre controle da Cannabis - RDC ANVISA nº 734 de 11/072022.
O Conselho Federal de Medicina decidiu dar início à abertura para a Cannabis de uso medicinal no Brasil. Entretanto, essa regulamentação com o passar dos anos, se tornou bastante restritiva, proibindo a aplicação do tratamento em crianças e adolescentes com epilepsias e refratárias aos tratamentos convencionais.
Procurando se alinhar aos avanços propiciados pela ANVISA, para a garantia do acesso, o Conselho Federal de Medicinal, publicou uma Consulta Pública, encerrada em 30.07.2022, para atualizar a Resolução 2.113/14. A expectativa é que essa revisão corrija a limitação da prescrição pelos médicos e garanta o pleno direito da garantia à saúde dos pacientes.
Em virtude da pressão exercida por pacientes e parentes, a ordem judicial a ANVISA promoveu a abertura do uso da Cannabis de uso medicinal, autorizando a importação de produtos à base de Canabidiol em 2015 pela Resolução da Diretoria Colegiada (RDC) nº 17/2015.
Além disso, a RDC 335/2020, revogando a RDC 17/2015, trouxe novos critérios e procedimento de importação de produtos à base de Canabidiol, simplificando o processo, com, por exemplo, a redução de documentos e informações que devem ser fornecidos pelo requerente.
Posteriormente, a RDC nº 66 de 2016 incluiu na Portaria SVS 344/1998 permissão excepcional de importação de produtos com CBD ou THC, atendidos os requisitos nela estabelecidos.
Já com a RDC nº 156/2017, a Anvisa incluiu a Cannabis na Denominação Comum Brasileira como planta medicinal.
A crescente demanda pela importação resultou em um grande aumento do tempo de manifestação da Agência, passível de provocar prejuízos à saúde dos pacientes que se utilizam deste mecanismo para continuidade dos seus tratamentos, fez com o texto da RDC 335/20 fosse alterado por meio da RDC nº 570/2021.
Atualmente os critérios para importação de produto de Cannabis para uso individual é RDC 660/2022, que consolidou as disposições da RDC 335/2020 e RDC 570/2021. A venda nas Farmácias foi viabilizada pela RDC 327/2019, tornando possível que empresas nacionais fabriquem, importem produtos acabados e comercializem os produtos à base de cannabis para fins medicinais, mediante concessão de autorização sanitária3.
É importante ressaltar que a aquisição em farmácias só pode ser feita sob prescrição médica, com retenção da receita (azul ou amarela)10.
Tabela 2 – Marco regulatório brasileiro sobre cannabis
5- Mercado
Segundo dados da consultoria BDSA, especializada no mercado de Produtos da Cannabis, o mercado legal no ano de 2020, atingiu o valor de US$ 21,3 bilhões, correspondendo a um aumento de quase 50% em relação ao ano de 2019, e deve seguir aumentando à medida que cada vez mais países autorizam o uso da cannabis para fins medicinais e/ou recreativos, com previsão de atingir US$ 55 bilhões em 20263.
Em outro relatório elaborado pela Whitney Economics, também uma consultoria especializada, o mercado da cannabis no Estados Unidos emprega atualmente cerca de 321 mil pessoas, 77 mil a mais que o ano de 20203.
No Brasil, segundo pesquisa realizada pela Consultoria Legislativa da Câmara dos Deputados no ano 2016, o Brasil poderia arrecadar até R$ 5,6 bilhões em tributos num cenário de legalização irrestrita de cannabis apenas com o uso recreativo. No mesmo estudo, os autores apontam que haveria uma economia anual com os presos por tráfico de cannabis na ordem de quase R$ 1 bilhão, considerando todo o aparato estatal envolvido3.
Possibilidades de geração de riquezas no Mercado Brasileiro
Existem muitas expectativas para ampliar e acelerar o mercado. Vejamos algumas:
➢ Autorizar a plantação da cannabis em território nacional (dotadas de segurança absoluta para impedir extravio e desvios) para fins medicinais, o que certamente traria inúmeros benefícios aos país, como o desenvolvimento do agronegócio e toda sua cadeia de suprimentos;
➢ Novos estudos científicos e novas tecnologias de medicamentos pela indústria;
➢ Aumento da produção nacional e redução dos preços finais aos consumidores;
➢ Arrecadação de tributos e geração de empregos;
➢ Redução de custos e ampliação de tratamento médico aos inúmeros pacientes que hoje necessitam da cannabis.
➢ Possibilidade de exportação de produtos acabados, devido à expertise brasileira na produção de medicamentos e à adequada base regulatória.
➢ Ampliação para outras classes de produto, como cosméticos, alimentos, medicamentos veterinários, papel, roupas, entre outros.
Comercialização
O mercado da cannabis medicinal está atingindo novos horizontes, expandindo os tipos de tratamento, sendo um deles específico para pets, afinal, existem diversas condições médicas que acometem os bichos de estimação.
Além do mercado farmacêutico humano e veterinário, de extrema importância para a saúde, em outros países como Canadá e EUA a diversidade de produtos é grande, alcançando também as áreas de cosméticos, suplementos alimentares, alimentos, produtos para saúde e vestuário.
Com isso, ampliam-se as possibilidades de utilização da Cannabis.
De acordo com o Guia SECHAT6 o total movimentado pelo mercado na América Latina e Caribe em 2020 foi de 168 milhões de dólares em termos de CBD. As projeções de crescimento desse segmento são atualizadas com muita velocidade, e a cada novo estudo os dados se tornam mais animadores.
A Prohibition Partners estima um mercado global de cannabis legal de 103,9 bilhões de dólares até 2024. Na análise, a América Latina aparece em quarto lugar no ranking de maiores mercados mundiais potenciais, com uma participação de 8,76%6.
A participação dos territórios é projetada da seguinte forma:
Europa, com 39,1 bilhões de dólares;
América do Norte e Canadá, com 37,9 bilhões de dólares;
Ásia, com 12,5 bilhões de dólares;
América Latina, com 9,1 bilhões de dólares;
Oceania, com 2,7 bilhões de dólares, e
África, com 2,6 bilhões de dólares.
Ainda na mesma projeção global, agora em termos de percentual de aplicação por segmento, o mercado medicinal ficaria com a maior fatia de participação, com 60,35% das vendas, o que representaria 62,7 bilhões de dólares. O segmento de uso adulto da cannabis ficaria com 39,65% do mercado, o que representaria 41,2 bilhões de dólares.
Segundo relatório da SECHAT6, a New Frontier12 estima que até 2023 o mercado de cannabis medicinal no Brasil atinja o valor de R$ 4,7 bilhões.
Atualmente, os Estados Unidos são líderes absolutos no faturamento no mercado global legal da cannabis. Segundo a consultoria especializada BDSA, em 2020, o país norte-americano ficou com 82,16% do volume mundial do faturamento, atingindo vendas de 17,5 bilhões de dólares.
Projeções indicam que o setor emprega cerca de 340 mil pessoas que se dedicam à produção, transporte e comercialização. Somente em impostos, o governo arrecadou cerca de 5 bilhões de dólares em 2019.
O Canadá, ainda segundo a BDSA, que apresentou crescimento de 61% no mercado legal de cannabis em 2020, ficou com 12,2% do faturamento global, registrando 2,6 bilhões de dólares em vendas6.
O restante do mundo ficou com apenas 5,16% de participação, vendendo apenas 1,1 bilhão de dólares. Em cinco anos, essa participação pode chegar a 8,8 bilhões de dólares.
6- Usos e concentrações permitidas
A definição do teor dos produtos à base de cannabis estão dispostos na RDC nº 327/201913 e seu artigo 4º diz:
Os produtos de Cannabis contendo como ativos exclusivamente derivados vegetais ou fitofármacos da Cannabis sativa, devem possuir predominantemente, canabidiol (CBD) e não mais que 0,2% de tetrahidrocanabinol (THC).
Estes produtos poderão conter teor de THC acima de 0,2%, desde que sejam destinados a cuidados paliativos exclusivamente para pacientes sem outras alternativas terapêuticas e em situações clínicas irreversíveis ou terminais.
Conforme o Artigo 10, os produtos de Cannabis estão autorizados apenas por via oral ou nasal, com qualidade farmacêutica para uso humano, sem adição de substâncias isoladas, sintéticas ou semissintéticas. Além disso, os produtos de Cannabis não podem conter substâncias que sejam potencialmente tóxicas nas dosagens utilizadas e não podem ser de liberação modificada, nanotecnológicos e peguilhados.
7- Fabricação e controle: o que é permitido e o que é vedado
Fabricação
O artigo 10, parágrafo 5º da RDC nº 327/2019, proíbe que produtos para fins não medicinais sejam produzidos: cosméticos, produtos fumígeros, produtos para a saúde ou alimentos à base de Cannabis spp. e seus derivados13.
O processo de fabricação não é complexo. Já é conhecido para os fitoterápicos tradicionais.
Conforme já mencionamos, o Brasil tem uma grande oportunidade para aumentar o número de empregos, aumentar a arrecadação de impostos, exportar produtos manufaturados e criar riqueza. Para tanto, deveria adotar uma legislação que permita o plantio controlado da planta (hoje proibido) e que permita a extração do óleo de Cannabis para a produção. Sabemos que a produção é permitida desde que se importe o extrato, o fitofármaco ou o produto acabado. Tudo isso encarece o produto para o consumidor e o país deixaria de sair suas divisas quando, de fato, poderia estar recebendo divisas.
Plantio
O processo começa com a perfeita seleção de sementes e seu aperfeiçoamento genético ao longo do tempo, para que possa ser obtida uma planta mais resistente e que produza mais.
O adequado plantio em área que receba quantidade de Sol e água, em solo sem contaminantes metálicos e agrotóxicos e colheita das flores na época certa, com rastreabilidade do tipo de planta, para possibilitar localizar isso no lote das flores e do produto. Essa rastreabilidade é importante para manter o histórico e conhecer a qualidade da planta.
Posteriormente deve-se fazer a secagem das flores e sua correta armazenagem, identificando o lote e o rastreamento do plantio a que pertence, bem como data de colheita e peso da embalagem. Aqui começa a primeira fase do processo, onde essa droga vegetal vai gerar o extrato. Por isso a identificação de lote e data é crucial para manter a rastreabilidade.
Extração
O processo produtivo começa, em realidade com a extração do óleo das flores de Cannabis. É um processo relativamente simples, semelhante aos processos de obtenção de extratos vegetais de outras plantas. Os equipamentos básicos de produção compõem-se de um extrator, onde a droga vegetal é mergulhada em um solvente por determinado tempo e sob agitação e um rotavapor, para eliminação do solvente e obtenção do extrato. O líquido resultante da evaporação e aquecimento é o extrato final, também chamado de óleo de Cannabis. Nesta fase pode ocorrer a descarboxilação dos canabinóides, na qual são convertidos de formas ácidas para formas descarboxiladas (por ex.: CBD-A C22H30O4 CBD C21H30O2), por meio da ação da luz e temperatura, principalmente.
Obrigatoriamente, como controle em processo farmacêutico, o extrato obtido deve ser padronizado, determinando as concentrações de THC e CBD.
Não estamos considerando aqui a obtenção de outros canabinóides, que possuem ações também importantes no sistema endocanabinóide, como Canabigerol (CBG), Canabinol (CBN), Canabicromeno (CBC) e Olivetol.
Produção e Envase
Para a produção do produto final, normalmente se utiliza equipamento de mistura de aço inoxidável com camisa de aquecimento e resfriamento para proceder à fabricação, na qual o extrato é disperso em um veículo oleoso ou agente emulsificante de uso farmacêutico e um agente estabilizante da solução. A filtração pode ser utilizada. Temperatura e tempos de mistura devem ser fixados e registrados em Instrução de Fabricação ou equivalente.
Todos os aspectos de controle em processo, bem como os demais, relativos às Boas Práticas de Fabricação devem ser obedecidos: validação de processo produtivo, validação de limpeza, validação de metodologias analíticas, qualificação de equipamentos e instrumentos, entre outros.
A padronização do extrato é requisito de Boas Práticas Farmacêuticas e exigência Regulatória para atingir a concentração desejada do produto final. O produto final deve ser dosado novamente para garantir que cada mililitro contenha a dosagem necessária do produto.
Terminada esta etapa, procede-se ao envase, principalmente em frascos de vidro âmbar e conta gotas de vidro ou gotejador embutido no frasco, tampa com lacre e rótulo. Cartucho com lacre de segurança é desejável.
O produto final é encaminhado ao almoxarifado para armazenagem e despacho, quando solicitado. O acesso deve ser restrito, com controle biométrico, senhas ou formulário manual.
Por tratar-se de produto controlado pela Portaria nº 344/1998 e suas atualizações10, é necessário controlar o estoque através de inventários cíclicos rotativos (entradas, saídas, perdas, amostras) desde o início:
1- Quantidade da droga vegetal obtida na colheita (flores) em peso;
2- Quantidade de extrato obtido em relação à quantidade de droga vegetal (flores) utilizada;
3- Quantidade de extrato usado na manipulação do produto final;
4- Quantidade de produto final envasado obtido.
5- Quantidade de produtos vendidos.
As análises de controle de qualidade para flores, extrato e produto final seguem a FB- Farmacopeia Brasileira ou outra farmacopeia aprovada pela ANVISA, caso a FB não disponha dos testes. Adicionalmente devem ser observadas as resoluções da ANVISA - RDC nº 26, de 13 de maio de 2014, que dispõe sobre registro de medicamentos fitoterápicos e o registro e a notificação de produtos tradicionais fitoterápicos e RDC nº 24, de 14 de junho de 2011, que dispõe sobre o registro de medicamentos específicos.
Controle de Qualidade da Droga Vegetal (flores)
No caso da Cannabis, o termo Droga vegetal refere-se às flores, nas quais originarão o extrato que, por sua vez, originará o produto final. Processos mais refinados levam à obtenção do princípio ativo isolado, pureza quase 100%, chamado de fitofármaco ou IFAV – insumo farmacêutico ativo fitoterápico.
Todas as fases do processo de obtenção da Droga vegetal, do Derivado Vegetal e do Produto acabado necessitam de controle de qualidade com as devidas especificações, capacitação de equipes e controles.
Vamos iniciar pela Droga Vegetal, que segundo Subseção I da Resolução RDC nº 26, de 13 de maio de 2014, em seu artigo 13, diz:
“Deve ser apresentado laudo de análise da droga vegetal, indicando o método utilizado, especificação e resultados obtidos para um lote dos ensaios abaixo descritos.......”.
e) determinação de metais pesados;
f) determinação de resíduos de agrotóxicos e afins;
h) determinação de contaminantes microbiológicos;
i) determinação de micotoxinas, ......
...........................................
Além destes, outros testes importantes são listados para o registro do fitoterápico.
Para análise rotineira das flores, a Farmacopeia Alemã - DAB 20184 - preconiza que os parâmetros de testes para a droga vegetal (flores) são: Aparência, Matéria Estranha, Tenuidade, Propriedades Microscópicas, TLC, Contaminação microbiológica, Aflatoxinas, Pesticidas, Metais Pesados, Perda por secagem, Ensaio e Substâncias Relacionadas.
Controle de Qualidade do Derivado Vegetal (extrato)
Os testes de rotina da produção sugeridos ao extrato, mas não se limitando a eles, são:
Aparência, Cor, Odor, Identificação de CBD e THC por HPLC, Teor de CBD e THC por HPLC, Bactérias Totais aeróbias, Fungos Totais, Umidade e Densidade8.
Tais testes são importantes para garantir a qualidade do extrato que originará o produto final, portanto, a entrada de uma matéria prima adequada, reduzirá eventuais problemas de qualidade no produto acabado.
O artigo 15 da Resolução RDC nº 26, de 13 de maio de 2014, diz que:
(...) para registro de fitoterápico, quando a empresa fabricante do fitoterápico utilizar derivados vegetais no seu processo de fabricação, deve ser apresentado laudo de análise, indicando o método utilizado, especificação e resultados obtidos para um lote dos ensaios abaixo descritos, entre outros:
I - solventes e excipientes utilizados na extração do derivado;
II - relação aproximada droga vegetal: derivado vegetal;
a) determinação de metais pesados;
b) determinação de resíduos de agrotóxicos e afins;
c) determinação de resíduos de solventes (para extratos que não sejam obtidos com etanol e/ou água);
e) determinação de micotoxinas, a ser realizada quando citados, em documentação técnico-científica, a necessidade dessa avaliação ou relatos da contaminação da espécie por micotoxinas;
Além disso, outros testes complementam a lista disposta nesta resolução mencionada acima.
Controle de Qualidade do Fitofármaco (Insumo ativo fitoterápico isolado)
Em face da inexistência de Monografia do fitofármaco Canabidiol na FB, utilizamos os mesmos conceitos presentes na Resolução RDC nº 654, de 24 de março de 2022, que dispõe sobre as Boas Práticas de Fabricação de Insumos Farmacêuticos Ativos – Capítulo XIX-
Insumos Farmacêuticos Ativos de Origem Vegetal e a Resolução RDC nº 359, de 27 de março de 2020, que Institui o Dossiê de Insumo Farmacêutico Ativo (DIFA) e a Carta de Adequação de Dossiê de Insumo Farmacêutico Ativo (CADIFA, para registro de Insumos Farmacêuticos Ativos.
Art. 11. O Dossiê de Insumo Farmacêutico Ativo (DIFA) deve atender, no que for pertinente, às diretrizes dos seguintes guias do ICH e seus documentos complementares:
I - ICH Q1A - Estudos de Estabilidade de Insumos Farmacêuticos Ativos e Medicamentos;
II - ICH Q1B - Estudos de Estabilidade: Estudos de Fotoestabilidade de Insumos Farmacêuticos Ativos e Medicamentos;
III - ICH Q1D - Agrupamento e Matrização para Estudos de Estabilidade de Insumos Farmacêuticos Ativos e Medicamentos;
IV - ICH Q1E - Avaliação de Resultados de Estabilidade;
V - ICH Q2(R1) - Validação de Procedimentos Analíticos;
VI - ICH Q3A(R2) - Impurezas em Novos Insumos Farmacêuticos Ativos;
VII - ICH Q3C(R6) - Impurezas: Guia para Solventes Residuais;
VIII - ICH Q3D(R1) - Guia para Impurezas Elementares, nos termos do ANEXO I desta Resolução;
IX - ICH Q6A - Testes e Critérios de Aceitação para Novos Insumos Farmacêuticos e Novos Medicamentos: Substâncias Químicas;
X - ICH Q11 - Desenvolvimento e Fabricação de Insumos Farmacêuticos Ativos (Entidades Químicas e Entidades Biotecnológicas/Biológicas); e
XI - ICH M7(R1) - Avaliação e Controle de Impurezas Reativas a DNA (Mutagênicas) em Medicamentos para Limitar Risco Carcinogênico Potencial.
Art. 14. Devem ser apresentados Denominação Comum Brasileira (DCB) ou Denominação Comum Internacional (INN), nome químico, número de registro CAS, nome compendial.
Art. 15. Devem ser apresentadas fórmula estrutural, com configuração estereoquímica, fórmula molecular e massa molecular relativa.
Art. 16. Deve ser apresentada relação de propriedades físico-químicas e outras propriedades relevantes, principalmente aquelas que afetam a eficácia e segurança do medicamento, como solubilidade, pKa, polimorfismo, isomerismo, coeficiente de partição (logP), permeabilidade e higroscopicidade.
Art. 18. Deve ser apresentado diagrama da rota de síntese ou processo de obtenção do IFA, a partir da introdução do(s) material(is) de partida.
Neste sentido, verificando os testes e informações técnicas solicitados no DIFA/CADIFA, é sensato utilizar, como sugestão, no controle de qualidade de rotina, estes testes:
Determinação do teor,
Identificação do fármaco,
Umidade,
Impurezas e
pH, dentre os mais críticos, devem fazer parte da rotina de análise do fármaco isolado.
Controle do Produto Acabado
Quando não especificado em Farmacopeia Brasileira ou farmacopeias estrangeiras permitidas, os testes recomendados a serem executados lote a lote, são:
Teor de água (Umidade)
Densidade
Índice de Saponificação (quando usado óleo fixo como excipiente)
Índice de Acidez (quando usado óleo fixo como excipiente)
Metais pesados*
Resíduos de agrotóxicos*
Teor em Canabidiol
Teor em THC
Outros Canabinóides
Microbiologia
*Se a empresa controla a entrada das MPs e extrato adequadamente, estes testes podem considerar os resultados da Droga vegetal, com base em Análise de Riscos adequada ao processo como um todo, desde o plantio até a produção.
8- Terceirização
Controle de Qualidade
A Empresa Contratante deve qualificar a Empresa Contratada e avaliar a sua competência no atendimento de requisitos de boas práticas laboratoriais por meio de:
I – habilitação junto à Rede Brasileira de Laboratórios Analíticos em Saúde (REBLAS) para os ensaios contratados;
II - disposições da Resolução RDC n° 11, de 16 de fevereiro de 2012 e suas posteriores atualizações;
III – Certificação de Boas Práticas de Fabricação, quando se tratar de empresa fabricante de medicamentos ou produtos biológicos;
IV – acreditação de acordo com a norma ISO 17025 para os ensaios contratados; ou
V – comprovação do cumprimento das Boas Práticas de Laboratório, conforme diretrizes reconhecidas internacionalmente.
A aprovação final para liberação do produto cabe à empresa Contratante, de acordo com os princípios de Boas Práticas de Fabricação e com os requisitos do registro.
Importante notar o que diz o artigo Art. 4° da RDC 268/ 201911:
É permitida a contratação parcial ou total dos serviços de terceiros para a realização dos ensaios de controle qualidade para os seguintes medicamentos:
I - dinamizados;
II - específicos, que contenham insumo farmacêutico ativo de origem animal ou vegetal; ou
III - fitoterápicos.
Nosso entendimento é que o controle de qualidade dos produtos de cannabis (um fitoterápico) pode ser realizado em laboratórios terceirizados contratados.
O art. 5° diz:
É permitida a contratação parcial ou total dos serviços de terceiros para a realização dos ensaios de controle de qualidade dos demais medicamentos, nas seguintes condições:
I - para os contratos entre empresas fabricantes de medicamentos;
II - para os contratos entre importadoras e fabricantes, somente quando o fabricante do medicamento figurar como a empresa contratada;
III - medicamentos integrantes do componente especializado da assistência farmacêutica com aquisição centralizada pelo Ministério da Saúde;
IV - medicamentos de risco, conforme Norma de Referência- NR 32 do Ministério do Trabalho que dispõe sobre segurança e saúde no trabalho em serviços de saúde;
V - medicamentos nanotecnológicos ou com sistemas terapêuticos implantáveis;
VI - medicamentos para doenças raras ou negligenciadas; ou
VII - ensaios para a quantificação de impurezas, microbiológicos ou determinação de microestrutura.
Laboratório de Controle da Qualidade e local de armazenamento das importadoras
O artigo 7º da RDC nº 268/201911 diz: Todas as importadoras devem possuir laboratório de controle de qualidade e local de armazenamento próprios, incluindo local específico para armazenamento de amostras de referência.
Parágrafo único. Além do disposto no caput deste artigo, a empresa deve possuir capacidade técnica e operacional para realizar as atividades necessárias, ou contratar os serviços de terceiros, conforme legislação específica.
Art. 8º O laboratório próprio da importadora situado em território nacional é responsável pela realização de ensaios completos de controle de qualidade, em conformidade com o registro do medicamento na Anvisa, para cada carga recebida, lote a lote, de todos os medicamentos importados.
Estes dois artigos devem ser interpretados juntamente com o artigo 4º acima. Fica claro que a empresa pode terceirizar controle de qualidade do produto, em sua totalidade ou parcialmente. Por outro lado, a empresa deve possuir espaço próprio para armazenagem dos produtos e das amostras de retenção.
9- Movimentos Legislativos para regular o uso da Cannabis
O ano de 2022 traça um caminho importante para o Brasil regular o uso da cannabis para fins medicinais, especialmente em virtude do calendário político.
Na ANVISA teremos a revisão da RDC 327/2019, que tem prazo de um novo texto regulatório publicado em dezembro de 2022. A consulta pública deve ser disponibilizada para contribuições em outubro de 2022 e é importante que as contribuições sigam o rigor científico e legal para que a nova Resolução atenda às necessidades reais dos pacientes e do mercado.
Como o assunto interfere com anseios políticos conflitantes, há a possibilidade de haver polarização política durante a revisão da RDC 327/19 e no Congresso Nacional, na discussão sobre o PL nº 399/2015 - Câmara dos Deputados e do PL 5295/19, proposta de iniciativa popular para uso da Cannabis -Senado Federal7.
É importante registrar que no Congresso Nacional estão os PLs em discussão: o PL 399/2015, os PL 7187/2014, PLS 514/2017, PL 5295/2019, PL 4776/2019 e PLS 5158/2019 que de uma ou outra maneira, regulamentam o plantio, o cultivo, comercialização e distribuição da Canabis para fins medicinais7 .
A aprovação, pela Câmara dos Deputados, do Projeto de Lei (PL) nº 399/2015, que passou por uma tramitação especial, propõe alterar o artigo 2º da Lei de Drogas, justamente para viabilizar o plantio, fabricação e a comercialização de medicamentos que contenham extratos, substratos ou partes da planta cannabis sativa em sua formulação, foi uma vitória importante para os pacientes, entretanto um recurso para leva-lo para ser aprovado no Plenário, paralisou o andamento legislativo desde 20217.
O esforço dos Estados e Municípios, merece especial atenção pois estão buscando, dentro da limitação Constitucional, customizar disposições que atendam às necessidades dos pacientes dos seus territórios, por meio de Leis, Programas ou em iniciativas legislativas locais.
Tabela 3 – Resumo do cenário atual sobre as propostas de legislações
O movimento legislativo representa uma grande oportunidade de negócios e de desenvolvimento desse mercado promissor e milionário. A criação de empregos nas diversas fases do processo de produção, distribuição e comercialização é bastante possível, assim como a possibilidade de criar riquezas, via exportação de manufaturados, já que território, clima, regulação aprimorada de BPF para os produtos da área da saúde e uma plataforma produtiva farmacêutica de excelência, colocam o Brasil como um grande player nesta área.
Possíveis avanços na lei e ampliações para outras classes de produtos (cosméticos, produtos para saúde, alimentos, têxteis, suplementos e alimentos) tornarão este mercado muito atraente para empresas de diversos segmentos.
10- Considerações finais
Os importantes e diretos reflexos sociais, determinam que o caminho para o uso da Cannabis para fins medicinais, seja por via do legislativo, regulatória ou judicial, não têm mais volta.
É inegável os diversos benefícios obtidos por pacientes portadores do Transtorno do Espectro Autista, da Epilepsia Refratária, da Doença de Parkinson, de Dores Crônicas e de Insônia sinalizados na literatura. Assim, não há como deixar de reconhecer que essa opção farmacológica, devidamente regulada e validada cientificamente, deve fazer parte do arsenal terapêutico na medicina brasileira.
Regulamentos e normas que impõem a legalidade e os critérios regulatórios são necessários para a gestão do risco que está intimamente relacionada ao estabelecimento das Boas Práticas de Segurança, necessárias para proteção à saúde. A segurança jurídica é um fator preponderante para trazer ao mercado farmacêutico da Cannabis o amparo aos marcos normativos da ANVISA e ao setor regulado. Além disso, disciplina a fabricação, estabelece as bases para o controle de qualidade e os controles adequados de farmacovigilância, tudo no sentido de garantir a segurança do paciente. Neste contexto, é necessário que seja entendida a indiscutível urgência e a relevância para a concretização, sem morosidade e preconceitos, da garantia desse Direito aos pacientes.
Referências
1- ELISALDO ARAÚJO CARLINI. A história da maconha no Brasil. The history of marihuana in Brazil. Disponível em: https://www.scielo.br/j/jbpsiq/a/xGmGR6mBsCFjVMxtHjdsZpC/?lang=pt. 2- ONU E A CANNABIS: as mudanças depois da reclassificação. 07/07/2021. Disponível em: https://thegreenhub.com.br/onu-e-a-cannabis-as-mudancas-depois-da-reclassificacao/. Acessado em: ago/2022. 3- PAULO DANIEL CICOLIN. A pauta legal do uso medicinal da cannabis no Brasil em 2022, 6 de outubro de 2021. Disponível em https://www.conjur.com.br/2021-out-06/cicolin-pauta-uso-medicinal-cannabis-brasil-2022. Acessado em: 14/09/2022.
4- FARMACOPEIA ALEMÃ - DAB 2018. Cannabisblüten Cannabis flos.
5- FARMACOPEIA ALEMÃ - DAB 2014. Analytical Monograph Cannabis Flos Version 7.1 / November 28, 2014.
6- GUIA SECHAT: SAÚDE E NEGÓCIOS DA CANNABIS. Edição 1, 2021. Disponível em: www.sechat.com.br. Acessado em 01/09/2022.
7- AGÊNCIA SENADO. Cannabis medicinal: realidade à espera de regulamentação. Fonte: Nelson Oliveira. Publicado em 6/8/2021. Disponível em: https://www12.senado.leg.br/noticias/infomaterias/2021/07/cannabis-medicinal-realidade-a-espera-de-regulamentacao. Acessado em 01/08/2022.
8- INSTITUTO FEDERAL DE MEDICAMENTOS E DISPOSITIVOS MÉDICOS ESCRITÓRIO DA COMISSÃO DE FARMACOPEIA. Projeto de Monografia de Extrato de Cannabis. RESULTADOS da 62ª reunião do Comitê de Biologia Farmacêutica da Comissão de Farmacopeia Alemã em 27 de setembro de 2019 - Bonn.
9- BRASIL. ANVISA. Resolução da Diretoria Colegiada - RDC nº 234, de 20 de junho de 2018.
Dispõe sobre a terceirização de etapas de produção, de análises de controle de qualidade, de transporte e de armazenamento de medicamentos e produtos biológicos, e dá outras providências.
10- BRASIL. Ministério da Saúde. PORTARIA/SVS Nº 344, de 12 de maio de 1998 e suas atualizações. Aprova o Regulamento Técnico sobre substâncias e medicamentos sujeitos a controle especial.
11- ANVISA. Resolução da Diretoria Colegiada - RDC nº 268, de 25 de fevereiro de 2019. Dispõe sobre alteração da Resolução da Diretoria Colegiada - RDC nº 234, de 21 de junho de 2018.
12- NEW FRONTIER DATA. Disponível em: https://newfrontierdata.com/ Acessado em: 01/09/2022.
13- ANVISA. Resolução da Diretoria Colegiada - RDC nº 327, de 9 de dezembro de 2019. Procedimentos para a concessão da Autorização Sanitária para a fabricação e a importação. Estabelece requisitos para a comercialização, prescrição, a dispensação, o monitoramento e a fiscalização de produtos de Cannabis para fins medicinais, e dá outras providências.
14- CARLINI, Elisaldo. Maconha (Cannabis Sativa): da "erva de diabo" a medicamento, ed. Ciência e Cultura. 1980.
15- ZUARDI, Antonio Waldo. History of Cannabis as a medicine: a review. Revista Brasileira de Psiquiatria, vol. 28, São Paulo, 2005.
AUTORES
Maria José Delgado Fagundes
Advogada especialista em Saúde Pública, Direito Privado, Bioética e Healthcare Compliance, com 34 anos no mercado. Atualmente é founder e CEO da MJDFAGUNDES – Consultoria Especializada em Saúde.
Jair Calixto
Farmacêutico, especialista em Boas Práticas de Fabricação, mais de 50 anos de experiência no setor farmacêutico. Atualmente é assessor/consultor para assuntos ligados às áreas técnicas da Indústria Farmacêutica
sexta-feira, 30 de setembro de 2022
quinta-feira, 1 de setembro de 2022
quinta-feira, 30 de junho de 2022
segunda-feira, 27 de junho de 2022
Proposta para realização de auditorias remotas em fornecedores
Proposta para realização de auditorias
remotas em fornecedores
A ANVISA estabeleceu, por meio do
Anexo VI do POP-O-SNVS-002, a condução da inspeção por meio remoto para os
entes da vigilância sanitária.
Diz uma parte do texto: “preferencialmente,
a autoridade local deve participar de forma presencial no estabelecimento
inspecionado, enquanto os demais entes participam de forma remota, por meio de
videoconferências”.
Isso significa a não obrigatoriedade
de estar fisicamente presente nas instalações, considerando o evento atual de
força maior, leia-se Covid19, mas na medida do possível deverá estar presente.
Segundo este anexo VI, a auditoria remota envolve as reuniões com a empresa, a análise documental, os
questionamentos sobre os processos produtivos, controle de qualidade e
almoxarifados, entre outros aspectos, avaliação virtual às áreas de fabricação
da empresa e a elaboração conjunta do relatório de inspeção.
E como fazer para que empresas
fabricantes de medicamentos possam utilizar este método com seus fornecedores
de produtos e serviços?
O advento da pandemia criou as
condições e os mecanismos necessários para aumentar a produtividade e
efetividade das atividades de inspeção, por meio remoto.
É possível utilizar esta ferramenta
para a rotina entre os entes privados? A resposta é sim, respeitadas
determinadas condições. É o que pontuo a seguir.
I. Decisão para realização de
auditoria remota
Não podemos (e, sobretudo, não
devemos) acreditar que auditoria remota será a solução mágica para todas as
dificuldades e desafios que a equipe de auditoria em fornecedores enfrenta,
pois não será. Em determinados casos não é possível realizar uma boa e
confiável auditoria unicamente pelo meio remoto.
Uma solução adequada seria a tomada de
decisão com base em uma análise de risco consubstanciada por elementos
técnicos, operacionais e de segurança pessoal e patrimonial, tanto para
auditores e auditados.
Concretamente, devemos levar em conta
os principais objetivos de uma auditoria que são: garantir a qualidade,
segurança e eficácia dos medicamentos entregues à população.
E assim, proponho a adoção de fatores
de risco que devem ser considerados na decisão:
a)
Pandemia do COVID-19: por razões do atual
momento, seria um fator crucial.
b)
Risco do próprio fornecedor, já
conhecido e determinado pela empresa: pode ser um IFA que tenha elevado
potencial de instabilidade, geração de impurezas que devem ser controladas
estritamente, pode ser um produto crítico da empresa (como estéril), IFAs com potencial
de sensibilidade, somente para citar alguns.
c)
Fatores estabelecidos por uma matriz
de risco: uma matriz de risco desenvolvida para classificar o grau de risco de
um fornecedor, estabelecendo os períodos entre uma auditoria e outra, se será
por meio remoto, misto ou presencial. Conforme o grau de severidade, poderá
servir de ferramenta para planejar as auditorias, partindo-se das mais críticas
para as de menor risco.
Deste modo, os fornecedores poderiam
ser classificados como:
Grau A:
podem ser auditados remotamente;
Grau B:
podem ser auditados remotamente (documentos, entrevistas, reuniões) e
presencialmente (visitas às instalações para verificar os locais de produção,
armazenamento, equipamentos e processos)
Grau C:
podem ser auditados unicamente por meio presencial.
II. Planejamento da inspeção
A inspeção remota não difere muito da
inspeção presencial nos seus aspectos de preparação e as atividades podem ser:
a)
A empresa deve ser comunicada com
antecedência suficiente e ser informada da auditoria por meio remoto.
b)
Empresa auditora e empresa auditada
devem possuir tecnologia de videoconferência e acesso à internet de boa
qualidade e velocidade.
c)
Uma lista de documentos que devem ser
digitalizados antecipadamente à inspeção e enviado à equipe de auditoria da
empresa.
d)
Realização de reuniões por
teleconferência para definição da agenda de auditoria.
e)
A empresa auditora pode seguir o
planejamento de inspeção e elaboração da agenda, conforme o seu procedimento interno
de auditorias presenciais.
III. Condução da inspeção
a)
Realização de reunião inicial com
todos os membros da equipe inspetora para esclarecer o fornecedor sobre as
atividades da inspeção.
b)
Realização de reuniões diárias entre
os membros da equipe por teleconferência para discussão do andamento da
inspeção, dos achados e possíveis trilhas de auditoria.
c)
A equipe remota pode realizar reuniões
adicionais com a empresa durante todo o decorrer da inspeção, para
esclarecimento de dúvidas quanto aos documentos avaliados e para solicitar
novos documentos, se necessário.
d)
A inspeção nas áreas de produção,
qualidade e almoxarifados deve ser feita com ferramenta de videoconferência
apropriada para que os auditores remotos possam acompanhar estas atividades.
e)
Definição de um meio formal (e-mail
institucional, pasta na nuvem ou outro meio definido pela equipe) para que a
empresa auditada forneça os documentos solicitados. Esta é uma situação
bastante importante, pois o sigilo, a confidencialidade e a segurança das
informações do fornecedores devem ser preservados.
f)
Definição de horários para as
atividades de inspeção remota a serem realizadas.
g)
Realização do fechamento da auditoria
em uma reunião por videoconferência apontando as não conformidades encontradas,
principalmente as críticas e instruindo o fornecedor a estabelecer prioridade
para solucionar estas não conformidades em um tempo que seja o mais breve
possível.
h)
Demais instruções para auditorias presenciais
podem ser seguidas no procedimento operacional da empresa auditora.
IV. Relatório de inspeção
As atividades de elaboração,
discussão, revisão e entrega do relatório de inspeção ao fornecedor devem ser
realizadas conforme previsto no procedimento interno da empresa auditora.
Nota: Em todas as reuniões virtuais/remotas, utilizar-se de
ferramenta de teleconferência segura, que atenda à equipe de auditoria e à
empresa auditada.
V. Comentários
finais
Nada
substitui uma auditoria presencial, pois presencialmente serão visualizados detalhes
e situações que remotamente são difíceis de serem observados ou percebidos.
Além disso, perde-se o benefício de estar presente questionando e observando os
executores dos processos, operações e atividades no exato momento de sua ocorrência.
Para
determinados insumos e fornecedores, assim como fabricantes de medicamentos
terceirizados, entendo que a auditoria presencial é crucial, mas uma situação
mista, baseada em análise de risco (remota + presencial) é bem razoável.
Em outros
casos, como o das embalagens secundárias e terciárias, dos excipientes não
críticos, dos serviços (exceto produção, controle de qualidade, armazenagem, distribuição
e transporte) a auditoria unicamente remota me parece bem aceitável.
Por isso, a
análise dos riscos envolvidos é importante ferramenta para a decisão e seleção
da auditoria remota.
Os
benefícios de economia de tempo em deslocamentos e o consequente aumento da
produtividade são grandes, sobrando assim, tempo adicional para uma elaboração
mais consistente do relatório final de auditoria.
Saudações a
todos e até o próximo artigo.
e-mail: jaircalixto@uol.com.br
Jair Calixto
Pharmalliance Assessoria Ltda. 08/05/2021
![]()
![]() jaircalixto.farma
jaircalixto.farma ![]() Jair Calixto Canal BPF
Jair Calixto Canal BPF
domingo, 19 de junho de 2022
Nanotecnologia: Benefícios e Desafios à inovação farmacêutica
Nanotecnologia:
Benefícios e Desafios à inovação farmacêutica
por Jair Calixto*
1) Sumário
Introdução
Histórico
Definições/Conceitos
Nanotecnologia
ciência
Aplicações
Fabricação
de produtos nanotecnológicos
Riscos/Toxicologia
Nanotecnologia
controlada
Nanotecnologia
descontrolada
2) Introdução
A
nanotecnologia é uma ciência que vem se desenvolvendo nas diferentes áreas do
conhecimento humano. Na área da saúde, sua maior evolução vem ocorrendo na
Cosmética, mas os avanços e os trabalhos demonstrados nas ciências
farmacêuticas são notórios e as possibilidades de obtenção de produtos
farmacêuticos nanotecnológicos são imensas e já há formas farmacêuticas
baseadas em nanotecnologia.
Termos como
nanomedicina e nanobiotecnologia já aparecem com freqüência no vocabulário
científico.
3) Histórico
A
nanotecnologia não é uma ciência recente, mas data de cerca de 200 anos. Desde
o século 18 já se conhecem produtos com aplicação de tecnologia de
nanopartículas.
Novo fenômeno
que se processa em escala nanométrica.
É uma eficiente
escala de fabricação:
–
Menos espaço
–
Menos energia
–
Mais Rápida
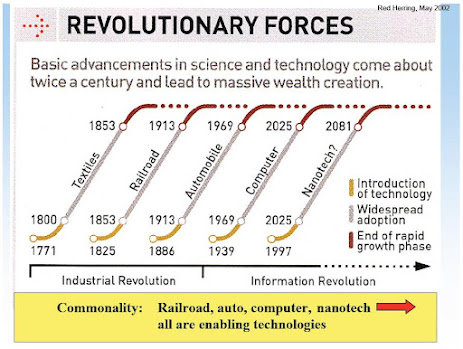
Figura 1- escala da evolução da ciência, desde a
revolução industrial.
A ciência e as aplicações
da nanotecnologia estão se desenvolvendo a um passo muito rápido. Em 1990, aproximadamente
1.000 publicações científicas sobre nanotecnologia foram publicadas e aproximadamente 200 solicitações de patentes (no mundo) foram feitas. Em 2002, o número de
publicações tinha alcançado mais de 22.000 com mais de 1.900 patentes. Este crescimento
exponencial em publicações científicas e patentes é o resultado da aumentada
descoberta e dos investimentos em nanotecnologia que, provavelmente resultará
em substanciais e contínuas mudanças em produtos.
4) Definições/Conceitos
•
Nanomedicina
“Nano” tem se tornado um clichê no mundo da descoberta de
medicamentos.
–
A
disponibilidade de fármacos no local desejado dentro de um sistema fisiológico.
–
Distribuição
fisiológica seletiva e manutenção dos níveis terapêuticos.
–
Desenvolvimento
de novos fármacos para o tratamento do câncer.
Nanotecnologia é um campo multidisciplinar – física e química
acopladas à biologia.
•
Nano-encapsulação
de fármacos pode resultar em à
–
Aumento da Biodisponibilidade.
–
Especificidade do alvo.
–
Distribuição
e manutenção seletiva fisiológica dos níveis terapêuticos em um sistema
fisiológico por longos períodos de tempo.
Estes parâmetros são controlados através da variação no
tamanho das nano-encapsulações.
Nanotecnologia é a criação de materiais utilizáveis e
funcionais, aplicações e sistemas, através do controle da matéria no
comprimento de escala nanômetro e exploração das propriedades físicas, químicas e biológicas
naquele comprimento de escala. Envolve a criação e uso de materiais e
dispositivos no nível das moléculas e átomos.
–
Pesquisa
em nanotecnologia começou com descobertas
de novas propriedades físicas e químicas de diversos materiais metálicos ou
baseados no Carbono que somente aparece em estruturas com
dimensões nanométricas.
Já a Nanomedicina,
refere-se a uma altamente específica intervenção médica em escala molecular para curar doenças ou
reparar tecidos danificados, tais como, os ossos, músculos ou nervos.
Nanopartículas
Nano partículas:
1-300 nm (?) – Limite de tamanho para 100 nm?
Moléculas orgânicas, moléculas de fármacos, pequenos peptídeos
possuem tamanho de 1-2 nm;
Proteínas estão entre 2-5 nm
Vírus estão entre 25-80 nm.
Preparações lipossomais são suspensões de partículas > que
150-200 nm.
Nano-contentores como lipossomas; nano-contentores encapsulando
fármacos e nanocarreadores, têm se tornado a mais importante área da nanomedicina.
•
Nanocarreadores
farmacêuticos objetivo-alvo para terapia de câncer e imagem.
•
Carreadores
de fármacos usados para administração parenteral são biodegradáveis, tamanho de
partículas pequeno, circulação prolongada, entrega com objetivo-alvo.
Quão
pequeno é "nano"?
Tecnicamente, um nanômetro é 1 bilionésimo de um metro.
São dimensões entre aproximadamente 1 e 100 nanômetros, conhecidos como nanoescala. Propriedades físicas, químicas e biológicas, não usuais, podem emergir em materiais na nanoescala. Estas propriedades podem diferir de importantes maneiras das propriedades do granel do material e dos átomos ou moléculas.
Figura 2 – Escala nanométrica. Referência: Dr. Salomon Stavchansky
Por que usar Nano?
|
size |
number |
Total Surface area |
|
1 cm |
1 cubo |
6 cm2 |
|
1 mm |
1000 cubos |
60 cm2 |
|
1 µm |
1 x 1012 cubos |
6.000cm2 |
|
1 nm |
1 x 1021 cubos |
60.000.000 cm2 (600km2) |
Tabela 1 – Escala de comparação nanométrica. Referência: Dra Nadia Bou Chacra
Resposta: porque
aumenta a superfície de contato, pelo aumento da área.
Nanotecnologia ciência
A
nanotecnologia é uma ciência multidisciplinar, que não existe isoladamente, mas
acompanhada de outras ciências conhecidas e desenvolvidas pelo homem, como:
•
Física
•
Química
•
Ciências dos Materiais
•
Biologia
•
Medicina
•
Agricultura
•
Ciências do meio ambiente
•
Fabricação
farmacêutica e Insumos Farmacêuticos Ativos
Assim, o
desenvolvimento de qualquer produto requer a interdisciplinariedade das áreas
envolvidas, cada uma com uma parcela importante de participação no processo.
5) Aplicações
As
possibilidades de uso são as mais diversas e podemos encontrar produtos
nanotecnológicos em várias áreas do conhecimento humano. São aplicações
conhecidas atualmente:
Automóveis
Mecânica
Tintas especiais
Cosméticos
Lentes para óculos
Melhoria na
transmissão de energia – supercondutores
Novas formas
de computação
–
Armazenagem de dados eletrônicos
Melhoria na qualidade dos alimentos.
Transportes
Indústria da Construção
Indústria Farmacêutica
Nanotubos de carbono
Eletrônica Molecular
Nanocircuitos Inorgânicos
Nanotubos de Proteínas
Genomica
Nanotecnologia Computacional
5.1) Produtos com
aplicações na área da saúde
•
Nanomedicamentos
Fármacos
formulados como nanocarreadores.
Um novo método confiando na nanotecnologia para medir as metástases
dos tumores pela detecção da quantidade circulante de células tumorais na corrente
sanguínea.
Nanomedicina baseada em câncer targeting.
Nanomedicina
•
Nanodiagnósticos
–
Identificar doenças no nível
molecular utilizando sondas
inteligentes que detectam sinais patológicos no nível das células in vivo e/ou
in vitro.
•
Medicina Regenerativa
–
Mecanismos
integrados de reparação humana com nanoestruturas, para tratar doenças, tais
como, COPD, cardiovasculares, alergias, osteoartrite, sistema nervoso central.
•
Nanodisposição de fármacos – Alvo
–
O
objetivo é gerenciar ADME, PK-PD, imunogenicidade e sistemas de bio-reconhecimento.
•
Formulação de medicamentos.
•
Rotas de Administração.
Nanotecnologia
em Sistemas Biológicos
•
Sistemas
de Nanodisponibilidade para otimizar de entrega de fármacos para órgãos-alvo.
–
Gens e proteínas carreadoras
–
Modificadores de superfície
•
Biomarcadores
–
Em diagnósticos.
–
No
monitoramento da progressão de doenças.
•
Preservativos para melhorar estabilidade.
•
Melhorar
a Farmacocinética.
Aplicações Médicas
•
Medicamentos
revestidos (cobertos)
•
Nanopartículas
para tratamento da asma
•
Nanosondas
para monitorar plaquetas de gordura
•
Nanofibras
para tratamento de cárie dentária
•
Nanoeletrodos
para recuperar a função cerebral
•
Nanopartículas
para tratamento da rejeição ao
transplante dos pulmões e coração.
•
Nanopartículas no tratamento do câncer
–
Modificação
da superfície de lipossomas
Medicina e Saúde
•
Eficiente
e Rápido sequenciamento do Genoma
–
Diagnóstico e Terapêutica
–
Sistema
de saúde efetivo, barato, usando dispositivos remotos e in vivo.
•
Novas
formulações e rotas para a entrega de fármacos.
•
Tecidos
e órgãos artificiais mais duráveis e resistentes à rejeição.
•
Sistemas
Sensores que detectam o aparecimento e a progressão de doenças
•
Reversão
e prevenção da cegueira através do cordão espinal e regeneração da retina.
•
Regeneração
do coração após infarto.
•
Cura da doença de Parkinson
•
Cura da doença de Alzheimer
•
Acesso a novas cartilagens
•
Reparação de ossos
•
Novos dentes
5.2) Produtos com
aplicações na área da saúde
Nanoemulsões
Nanoemulsões para aplicações intravenosas
•
nutrição parenteral
•
nanoemulsões como sistemas de liberação de
fármacos
Nanoemulsões para administração
oral
Nanoemulsões para
aplicações dermatológicas
|
|
Nanocristais
Produtos
farmacêuticos orais
Produtos
farmacêuticos tópicos
Cosméticos
Suplementos nutricionais
Agroquímicos
Exemplos de nanocristais, comparando-os com macrocristais
Nanoparticulas lipídicas
•
Nanoparticulas lipídicas no estado sólido:
Derivadas de emulsões
O/A, simplesmente substituindo o líquido lipídico (= óleo) por um um sólido lipídico (i.e. sólido à temperatura
corporal)
•
SLN – Nanopartículas
Lípicas Sólidas
Produzidas
de sólidos lipídicos apenas
•
NLC – Carreadores
Lipídicos Nanoestruturados:
Produzidos de misturas de lipídeos sólidos
e líquidos, mas as partículas estão no estado sólido à temperatura corporal.
Produtos comerciais:
- aplicação
dermatológica
- administração oral (fármacos pobremente solúveis)
Figura 4 - mecanismo de liberação de fármacos
usando NLC
Lipossomas
Os lipossomas são partículas
(pequenas esferas) microscópicas de lipídeos (gorduras) que, graças à porção
hidrofílica dos seus constituintes, retêm água na sua estrutura podendo
encapsular substâncias de naturezas diversas (Figura 2). Estas partículas esféricas de lipídeos possuem
tamanhos que variam de algumas dezenas de nanômetros (1 milhão de vezes menor
que 1 milímetro) a alguns micrômetros (1000 menor que 1 milímetro), apenas
visíveis em microscópios de alta resolução.
Na área da cosmética, os
lipossomas são utilizados, tanto para aumentar a incorporação de substâncias
ativas nas células, como veículos de libertação controlada de princípios
ativos. Têm sido empregados na prevenção da queda de cabelos, promoção do
crescimento capilar, desaceleração do processo de envelhecimento da pele, clareamento
da pigmentação cutânea e prevenção e tratamento da lipodistrofia ginóide
(vulgarmente conhecida por celulite).
Possuem capacidades de hidratação e de nutrição da pele, além de poderem
servir de veículos a outras substâncias, nomeadamente, vitaminas e fármacos de
ação tópica como anti-inflamatórios e antifúngicos.
Além da sua aplicação mais generalizada em produtos
cosméticos, recentemente tem sido
investigada a possibilidade de utilizar os lipossomas para fármacos como aqueles
utilizados em oncologia e de alguns antibióticos. Neste caso, os lipossomas
apresentam a grande vantagem de permitirem veicular o princípio ativo no local
a ser tratado e promover a liberação controlada e localizada do fármaco.
Figura 5 - (A): Lipossoma unilamelar contendo substâncias ativas solubilizadas na fase aquosa e na bicamada lipídica; (B) Corte transversal de lipossoma unilamelar. (Figuras obtidas de Chorilli et al., 2004, Infarma 16 (7-8): 75), do trabalho Lipossomas e as suas aplicações na actualidade - Célia Antunes - Universidade de Évora – Departamento de Química
Microemulsões
Não é uma emulsão real.
Ø Não é uma emulsão em
tamanho micro!
Ø Nome foi criado antes
do nome „nanoemulsões“
Ø Nome significa menor
que macroemulsões
Composição das microemulsões
Ø Fase água
Ø Fase óleo
Surfactante e co-surfactante
![]() Propriedades:
Propriedades:
Ø Termodinamicamente estável
Ø Auto formadora
Ø Tensão interfacial de 0!
Ø Solução crítica
Ø Aparência clara
Ø Normalmente baixa viscosidade. Produtos:
Ø Capsoft (dermal)
Ø Voltaren Emugel (dermal)
Ø Sandimmun Optoral (oral)
Produtos
farmacêuticos,
contendo nanopartículas, já foram liberados e aprovados para
comercialização:
− Lipossomas
(i.e. Caelyx, Myocet);
−
Substâncias Poliméricas (i.e. Copaxone);
– Produtos usando tecnologia NanoCrystal
(Rapamune, Elan Drug Technologies);
–
Nanopartículas de Albumina (Abraxane).
6) Fabricação de produtos
nanotecnológicos na área farmacêutica
Produtos nanotecnológicos na forma
de pós ou comprimidos, que poderiam possuir a capacidade de liberar partículas
ao meio ambiente, deverão ser manipulados e fabricados em áreas segregadas, com
eficiente sistema de exaustão de pós e filtros adequados. Hoje produtos como hormônios,
citostáticos, antibióticos, entre outros já têm a obrigatoriedade de serem
fabricados em áreas segregadas, com fluxo exclusivo e sistema de ar
independente, de modo a evitar a contaminação de pessoas e produtos.
Produtos líquidos e suspensões não correm estes riscos, pois
a sua forma evita a contaminação do ambiente.
7) Riscos/Toxicologia
Podemos dividir em Nanotecnologia controlada
e Nanotecnologia não controlada. A nanotecnologia controlada possui controle
adequado, provoca benefícios aos pacientes, tem um balanço e equilíbrio entre
resultados e efeitos adversos.
Nanopartículas
menores, da ordem de 1 – 20nm, possuem longo tempo de
residência na corrente sanguínea e baixa do sistema vascular para os espaços intersticiais
Nanopartículas
de 30 – 100 nm são suficientes para evitar vazamentos para dentro
dos capilares e evitar o sistema reticuloendotelial
Nanopartículas
maiores que >100 nm parecem ser
filtradas mais facilmente no organismo.
7.1) Nanotecnologia
controlada
Instalações, EPI, EPC
Para produtos que possam ser extravasados para o ambiente e
provocar algum
risco para os profissionais que manipulam
o produto é necessário o uso de máscaras, luvas, roupas especiais, salas
especiais com pressão positiva. Este procedimento é comum atualmente para os
produtos hormonais, citostáticos e antibióticos. Atualmente a produção de
certos medicamentos é realizada por meio de áreas segregadas (certos
antibióticos, hormônios, citostáticos). A RDC nº 17/2010 contém requisitos, em
seu artigo 125, que limitam a fabricação
destes produtos, de modo que eles sejam fabricados em áreas únicas, sem
misturas com outros produtos.
Liberação e aprovação por órgão regulador, baseada em testes
clínicos.
Avaliação de efeitos colaterais e secundários, indesejados,
como outro fármaco qualquer, antes de ser introduzido na terapia.
Os efeitos adversos têm relação com farmacovigilância,
devidamente regulados e controlados pela ANVISA. Todo e qualquer medicamento
deve conter relato de efeitos colaterais e efeitos adversos constantes do
dossiê de registro de um medicamento. A aprovação da ANVISA certifica que a
indústria pode comercializar o medicamento. Estes são os riscos maiores dos
produtos nanotecnológicos e caberá à indústria provar a segurança dos
medicamentos para ter seu produto aprovado.
Todos os estudos encontrados até agora dizem respeito à
pesquisa de efeitos adversos dos
produtos quando ingeridos ou
aplicados por meio de suas diversas formas farmacêuticas, como em qualquer
pesquisa farmacêutica. A diferença é que estamos conhecendo agora os
nanoprodutos e assim, no futuro breve teremos mais informações e formas de
controlar estes efeitos. Como toda ciência e todo desenvolvimento.
Alguns estudos de inalação de partículas nanométricas referem-se
a produtos da indústria mecânica, tintas, de materiais, poluição, etc. Não há
relação destes com a indústria farmacêutica.
7.2) Nanotecnologia
descontrolada
É aquela derivada de partículas oriundas da poluição
ambiental, dos automóveis, dos fumos produzidos pelas indústrias de diferentes
setores.
8) Conclusões
ü Nanomedicamentos são uma importante
tecnologia para novos medicamentos e novas formas de administração, com atuação
direta nos sítios de ação. Esta nova forma de disponibilização do fármaco
reduzirá efeitos colaterais e indesejáveis, pela diminuição dos fármacos no
sistema circulatório, alocando-o diretamente no alvo=sítio de ação (célula,
órgão, molécula).
ü Nanomedicamentos não serão produtos
farmacêuticos bem-sucedidos até que tenham sido investigados e estudados os vários
aspectos de Qualidade, como a estabilidade.
ü É preciso esforços do Brasil para acompanhar o
desenvolvimento desta ciência, com a implantação de centros, desenvolvimento de
estratégias, implemantação de estruturas e aplicação de recursos. O MDIC já
começa a atuar em alguns campos da Nanotecnologia.
ü Para os nanomedicamentos emergentes
serem bem sucedidos, juntamente com sua Eficácia e Segurança, os aspectos de Qualidade
incluindo estabilidade farmacêutica, devem ser investigados.
ü Produtos como nanoemulsões,
lipossomas, microemulsões, já estão no mercado há muito tempo e não se tem
notícia de problemas de toxicidade. Os cosméticos foram pioneiros neste campo.
REFERÊNCIAS
Salomon Stavchansky, Ph.D.- Alcon
Centennial Professor of Pharmaceutics The
University of Texas at Austin College of Pharmacy Austin, Texas 78731
Vinod P. Shah, Ph. D. - Pharmaceutical
Consultant – FIP
Nadia Bou
Chacra, Prof. Dra. – Faculdade de Ciências Farmacêuticas – USP.
Profa.
Dra. Maria Helena Andrade Santana – Faculdade de Engenharia Química
da UNICAMP.
Prof. Rainer Miller – Universidade de Berlim - Alemanha
Profa. Cornelia M. Keck – Universidade de Berlim - Alemanha
24 Agosto, 2011
**Jair Calixto é farmacêutico e consultor, tendo vivência
de 50 anos na área farmacêutica
e-mail: jaircalixto@uol.com.br
![]()
|
||||||||||
 |
||||||||||
 |
||||||||||
|
||||||||||